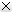Bao giờ có vaccine COVID-19 sản xuất trong nước?
Chiến dịch tiêm vaccine đã thành công, tiếp tục thực hiện ''đa mục tiêu'' / Bộ Y tế khẳng định EVUSHELD là thuốc, không phải "siêu vaccine"
Trong hoàn cảnh dịch bệnh bùng phát và chưa có vaccine vào đầu năm 2020, việc các công ty, đơn vị trong nước khởi động nghiên cứu và phát triển vaccine phòng COVID-19 là tín hiệu vui thời điểm đó.
Tuy nhiên, đến thời điểm này, 4 đơn vị tham gia cuộc đua gồm Công ty TNHH MTV vaccine và sinh phẩm Số 1 Vabiotech, Trung tâm Polyvac, Viện Vaccine và sinh phẩm y tế Nha Trang (nghiên cứu Covivac), Công ty cổ phần công nghệ sinh học dược Nanogen (nghiên cứu vaccine Nanocovax) cùng tập đoàn Vingroup (đơn vị nhận chuyển giao công nghệ vaccine ARCT-154) đều không đạt được mục tiêu lộ trình nghiên cứu đã đề ra.
Vaccine made in Việt Nam… giờ ra sao?
Covivac - sản phẩm của Viện Vắc xin và sinh phẩm y tế Nha Trang đã thử nghiệm lâm sàng giai đoạn hai. Báo cáo giữa kỳ nghiên cứu lâm sàng giai đoạn hai của nhóm nghiên cứu cho biết, vaccine sinh kháng thể trung hòa cao hơn vaccine của AstraZeneca, có triển vọng, đạt yêu cầu về tính an toàn và sinh miễn dịch. Viện Vắc xin và sinh phẩm y tế Nha Trang dự kiến đưa Covivac ra thị trường cuối năm 2021 đầu 2022, có thể cung cấp 6 triệu liều vaccine một năm. Thế nhưng Covivac hiện đã dừng ở nghiên cứu giai đoạn hai, hoãn thử nghiệm giai đoạn ba. Đại diện nhóm nghiên cứu Covivac cho biết không thể tìm được đủ người tình nguyện chưa tiêm vaccine COVID-19 để tham gia nghiên cứu giai đoạn ba.

Trên website của viện, thông qua bài viết "COVIVAC: Sự chìm nổi của một vaccine Việt" có dẫn ra các nguyên nhân: việc thử nghiệm lâm sàng giai đoạn 3 đối với vaccine Covivac cần phải được thực hiện với cỡ mẫu lớn hơn, tức quy mô thử nghiệm trên người nhiều hơn và đó là một thách thức.
Bởi "trước hết không còn đủ người chưa tiêm vaccine hoặc chưa nhiễm COVID-19 để tham gia thử nghiệm... Sự khốc liệt của dịch bệnh và tốc độ tiêm chủng thần tốc ở Việt Nam đã khiến việc thử nghiệm theo phương thức thông thường trở nên không khả thi".
Cũng theo bài viết trên, trường hợp IVAC tiếp tục thử nghiệm hoàn thành, vượt được rào cản thử nghiệm lâm sàng giai đoạn cuối thì "cánh cửa đến quyết định chấp thuận cấp phép khẩn cấp vẫn có thể đóng sập trước mặt.
Bởi quyết định này sẽ đòi hỏi một lượng kinh phí rất lớn, vượt quá khả năng tài chính của một đơn vị hoạt động theo cơ chế sự nghiệp công lập như IVAC".
Cho đến nay, IVAC chỉ mới được Chính phủ đồng ý cấp hơn 8 tỷ đồng từ Quỹ vaccine để bổ sung cho phần kinh phí còn thiếu ở giai đoạn 1 và 2. Viện đã tìm kiếm nguồn kinh phí để thực hiện giai đoạn 3 nhưng không ra.
Trong khi đó, vaccine Arct-154, vaccine mRNA do Tập đoàn Vingroup nhận chuyển giao công nghệ, cũng chuẩn bị hoàn tất thử nghiệm lâm sàng giai đoạn 3b. Dù triển khai nhanh nhưng cơ hội cho vaccine này tại Việt Nam để tiêm mũi cơ bản (như vai trò của vaccine trong nghiên cứu thử nghiệm lâm sàng) là hoàn toàn không có.
Hai đơn vị còn lại là Polyvac và Vabiotech đã dừng ở nghiên cứu tiền lâm sàng vaccine.
Nanocovax - ứng viên sáng giá nhất, trong 1 báo cáo đăng tải trên https://www.medrxiv.org/ (một hệ thống mở, nơi các nhà nghiên cứu chia sẻ những phát hiện ban đầu trước khi được bình duyệt, đánh giá bởi hội đồng thẩm định chuyên môn của các tạp chí y khoa) ngày 22/3 đã công bố kết quả nghiên cứu thử nghiệm lâm sàng giai đoạn 3.
Cụ thể: Vào ngày thứ 42-90 sau tiêm, hiệu lực bảo vệ đạt 86,7%, sau tiêm 120 ngày còn 78,5% và giảm còn 51,6% sau 180 ngày. Hiệu quả bảo vệ ngăn diễn biến nặng là 92%, bảo vệ khỏi tử vong là 100%.
Theo các số liệu về độ an toàn, khả năng sinh kháng thể và hiệu lực trong báo cáo được đăng tải thì vaccine của Nanocovax không hề kém các vaccine đang cấp phép ở Việt Nam và thế giới – một chuyên gia nhận định.
Hiệu lực bảo vệ ca nhiễm có triệu chứng từ ngày 42 (tức ngày 14 sau mũi 2) tới ngày 90 (2 tháng sau mũi 2) là mốc quan trọng để so sánh với các vaccine phương tây. Các thử nghiệm lâm sang của Pfizer, Moderna, Astra Zeneca đều báo cáo hiệu lực ở mốc này lúc xin cấp phép – chuyên gia này cho biết.
Tuy nhiên đến thời điểm hiện tại, vaccine Nanocovax này vẫn chưa được cấp phép sử dụng, mà vẫn cần bổ sung số liệu theo yêu cầu của Bộ Y tế.
"Gỡ khó" cho quá trình nghiên cứu vaccine nội
Thứ trưởng Bộ Y tế Trần Văn Thuấn trong một cuộc họp mới đây đề nghị chuyển hướng nghiên cứu vaccine nội theo mục tiêu sử dụng để tiêm liều nhắc lại, trên cơ sở tham khảo kinh nghiệm các nước.
Cục Quản lý dược xây dựng, ban hành hướng dẫn tiêu chí cấp phép vaccine COVID-19 sản xuất trong nước với chỉ định cho liều nhắc lại, hoàn thành trước ngày 30/3.
Cục Khoa học công nghệ và đào tạo hướng dẫn xây dựng Đề cương nghiên cứu thử nghiệm lâm sàng liều nhắc lại đối với vaccine COVID-19 sản xuất trong nước, theo dõi, kịp thời báo cáo những bất cập, khó khăn trong triển khai các nghiên cứu thử nghiệm lâm sàng vaccine, thuốc điều trị COVID-19 để xử lý kịp thời.
Vụ Kế hoạch - tài chính hướng dẫn các đơn vị thủ tục cấp kinh phí cho các nghiên cứu thử nghiệm lâm sàng vaccine COVID-19 sản xuất trong nước từ nguồn ngân sách nhà nước, định hướng đề xuất đề tài cấp quốc gia.
Bước chuyển hướng này của Bộ Y tế được cho là để "gỡ khó" quá trình nghiên cứu vaccine nội.
Trả lời phóng viên VOV2 về chủ trương này, thành viên của nhóm thử nghiệm lâm sàng vaccine Nanocovax cho biết: việc cấp phép khẩn cấp vaccine nội ở thời điểm không còn nhiều ý nghĩa. Theo kế hoạch, hết tháng 3/2023 vaccine Nanocovax mới chính thức hoàn thành thời gian thử nghiệm lâm sàng.
Để Nanocovax được cấp phép theo hướng liều nhắc lại cần phải đạt tiêu chí do Bộ Y tế quy định (việc này hiện Bộ Y tế đang giao cho Cục Quản lý dược xây dựng và ban hành) – thành viên nhóm thử nghiệm lâm sàng vaccine Nanocovax chia sẻ.
Nếu COVID -19 cần tiêm nhắc lại hàng năm, việc tự chủ về vaccine là rất có lợi. Cụ thể sẽ giúp chúng ta chủ động với các đợt dịch sau, các mũi nhắc lại, và tiết kiệm kinh phí. Tuy nhiên với lộ trình như đang thực hiện, có lẽ người dân vẫn tiếp tục chờ đợi.
End of content
Không có tin nào tiếp theo